一、实验设计核心要素
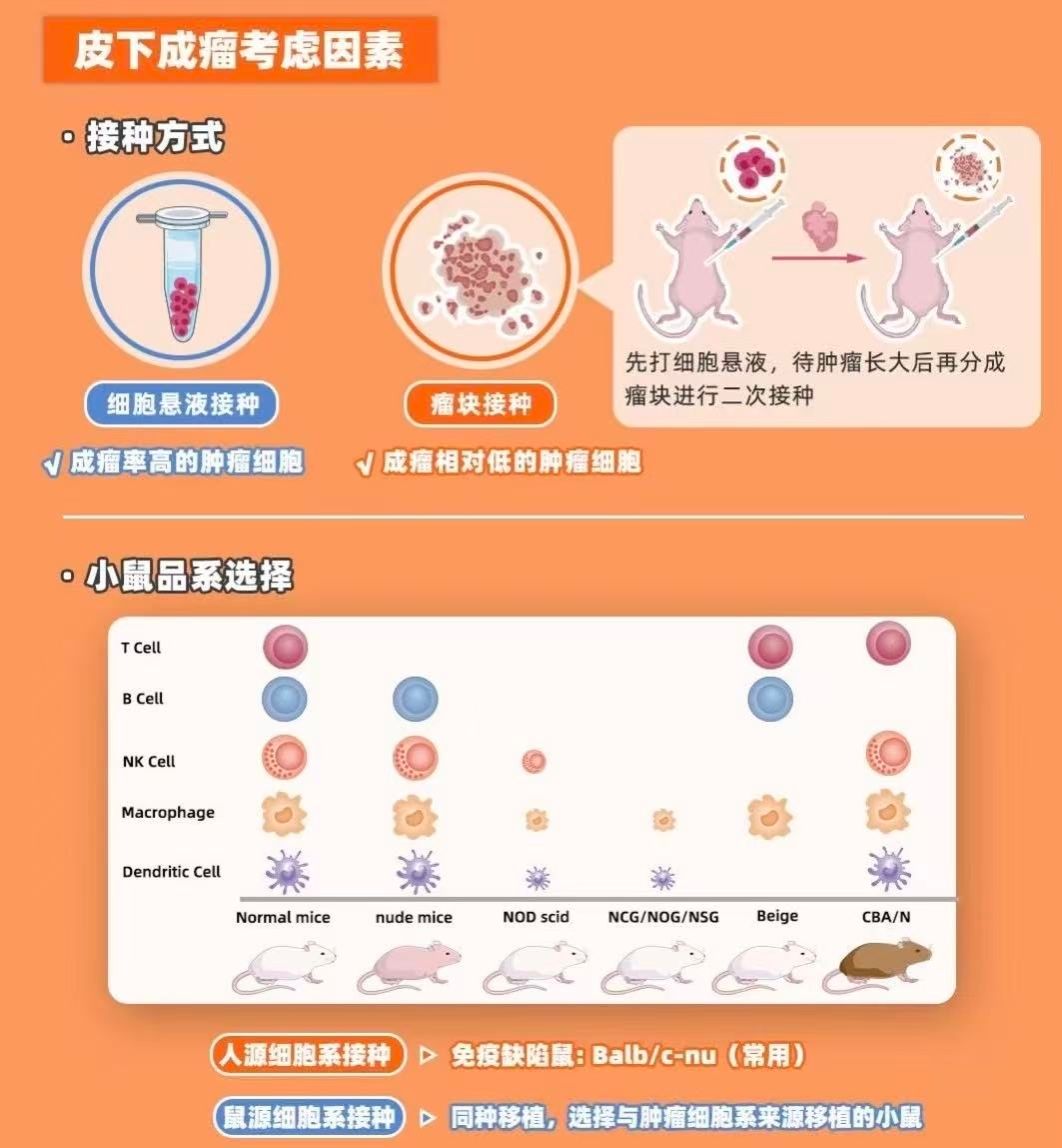
裸鼠选择常用品系:BALB/c-nu、NOD/SCID等,需根据肿瘤细胞类型选择免疫缺陷程度匹配的品系。
周龄与性别:通常选用4-6周龄雌性裸鼠。
饲养条件:SPF级环境,饲料、垫料及饮水需灭菌处理。
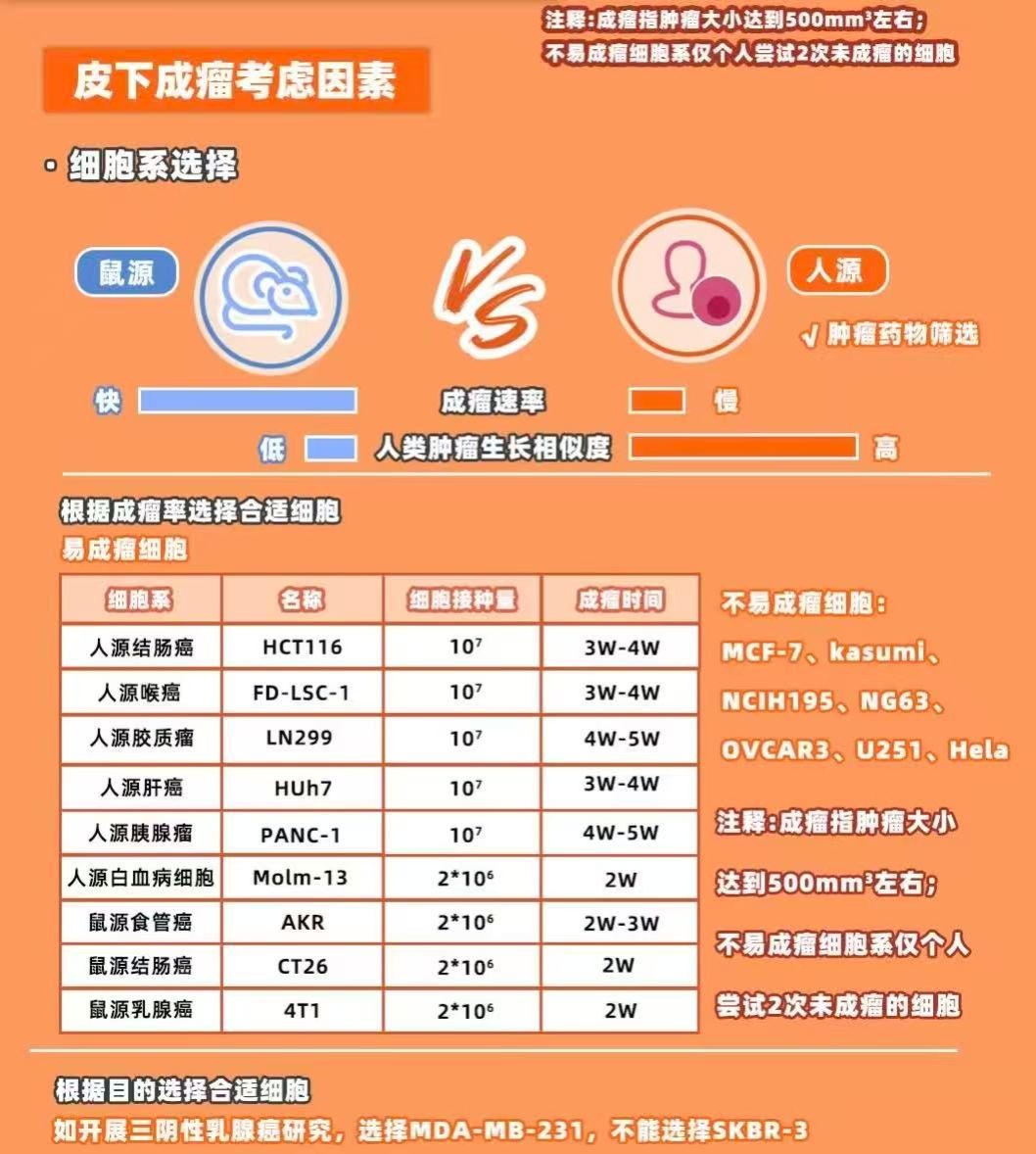
肿瘤细胞准备细胞来源:人源肿瘤细胞系(如A549、HCT116)或患者来源的异种移植(PDX)细胞。
细胞状态:接种前需处于对数生长期,活率>95%(可通过台盼蓝染色或流式细胞术检测)。
接种浓度:一般为1×10⁶-1×10⁷个细胞/mL,接种体积100-200 μL/只。
实验分组设计对照组:接种肿瘤细胞+溶剂(如PBS)。
实验组:接种肿瘤细胞+待测药物(需设置剂量梯度)。
样本量:每组至少6-8只裸鼠,以满足统计学要求。
二、操作关键步骤
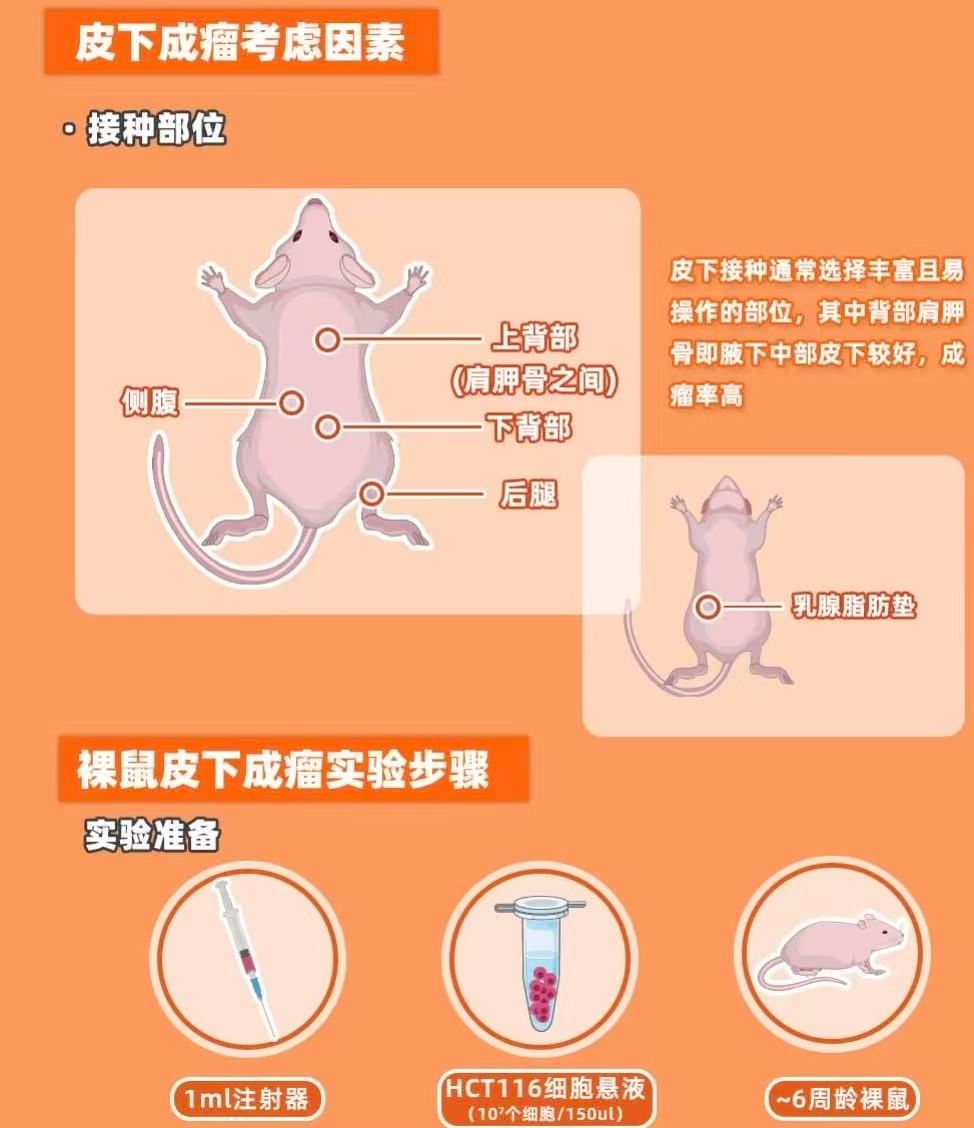
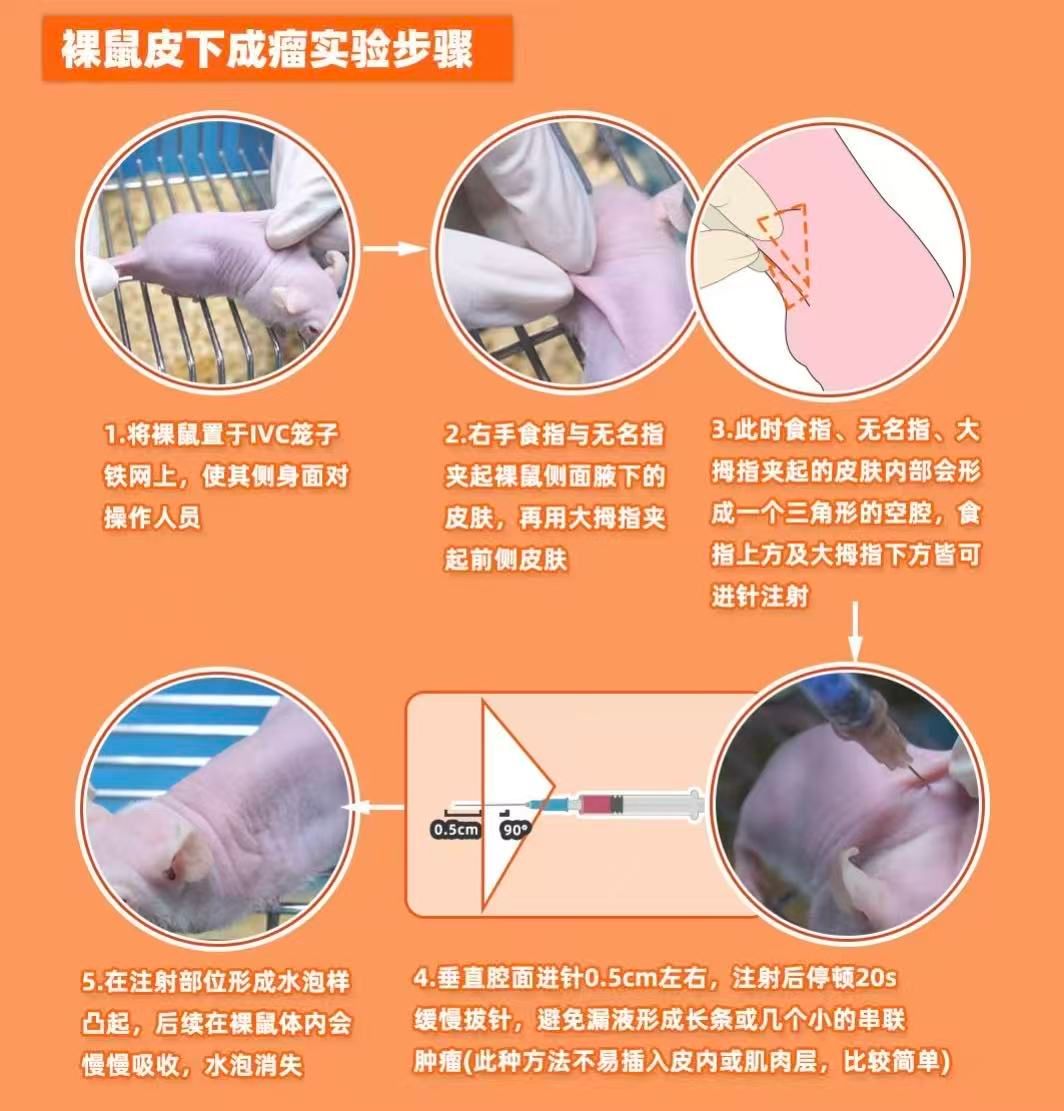
接种部位选择常用部位:裸鼠右侧或左侧腋窝皮下(血供丰富,易于操作)。
操作要点:裸鼠固定:用拇指和食指轻轻提起背部皮肤,使其呈“鼓包”状。
注射角度:针头与皮肤呈30°角刺入,避免穿透肌肉层。
注射速度:缓慢推注,避免细胞悬液外渗。
接种后观察每日观察:裸鼠精神状态、活动度、体重变化及接种部位有无红肿、破溃。
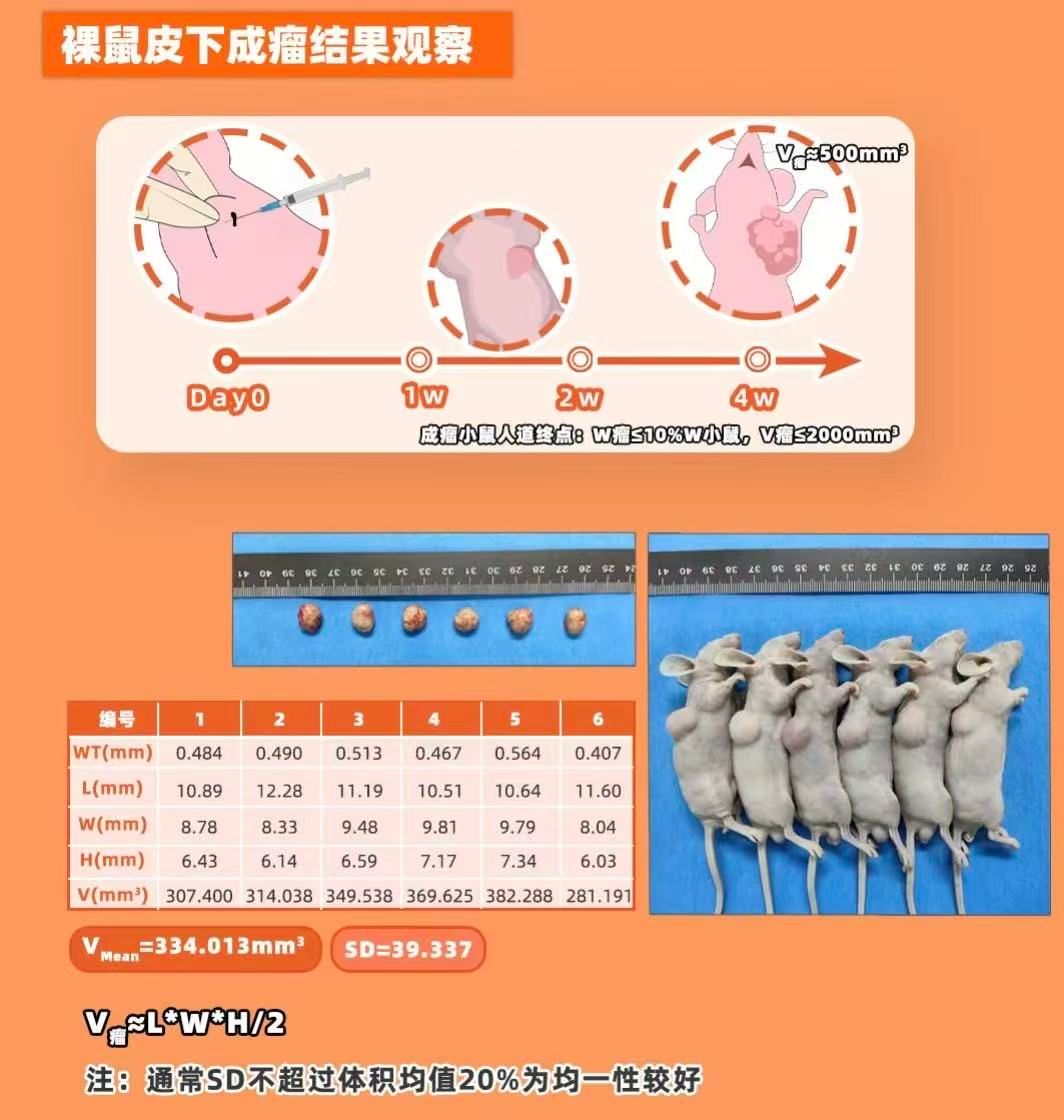
肿瘤测量:从接种后第7天开始,用游标卡尺测量肿瘤长径(a)和短径(b),计算体积(V=0.5×a×b²)。
终止标准:肿瘤体积达1500-2000 mm³或裸鼠出现明显消瘦、活动减少时,需终止实验。
常见问题与解决方案
成瘤率低可能原因:细胞状态差、接种浓度不足、注射技术不当。
解决方案:优化细胞培养条件,增加接种细胞数,改进注射手法。
肿瘤生长不均一可能原因:细胞悬液浓度不均、注射体积差异。
解决方案:使用自动细胞计数仪,严格标准化接种流程。
裸鼠死亡可能原因:感染、肿瘤过大压迫内脏。
解决方案:加强饲养环境消毒,及时终止实验。
三、数据分析与结果解读
肿瘤生长曲线以时间为横轴,肿瘤体积为纵轴,绘制生长曲线。
统计分析:采用双因素方差分析(Two-way ANOVA)比较组间差异。
实验局限性
免疫缺陷背景裸鼠缺乏T细胞功能,但仍有NK细胞和巨噬细胞活性,可能影响部分免疫治疗药物的评价。
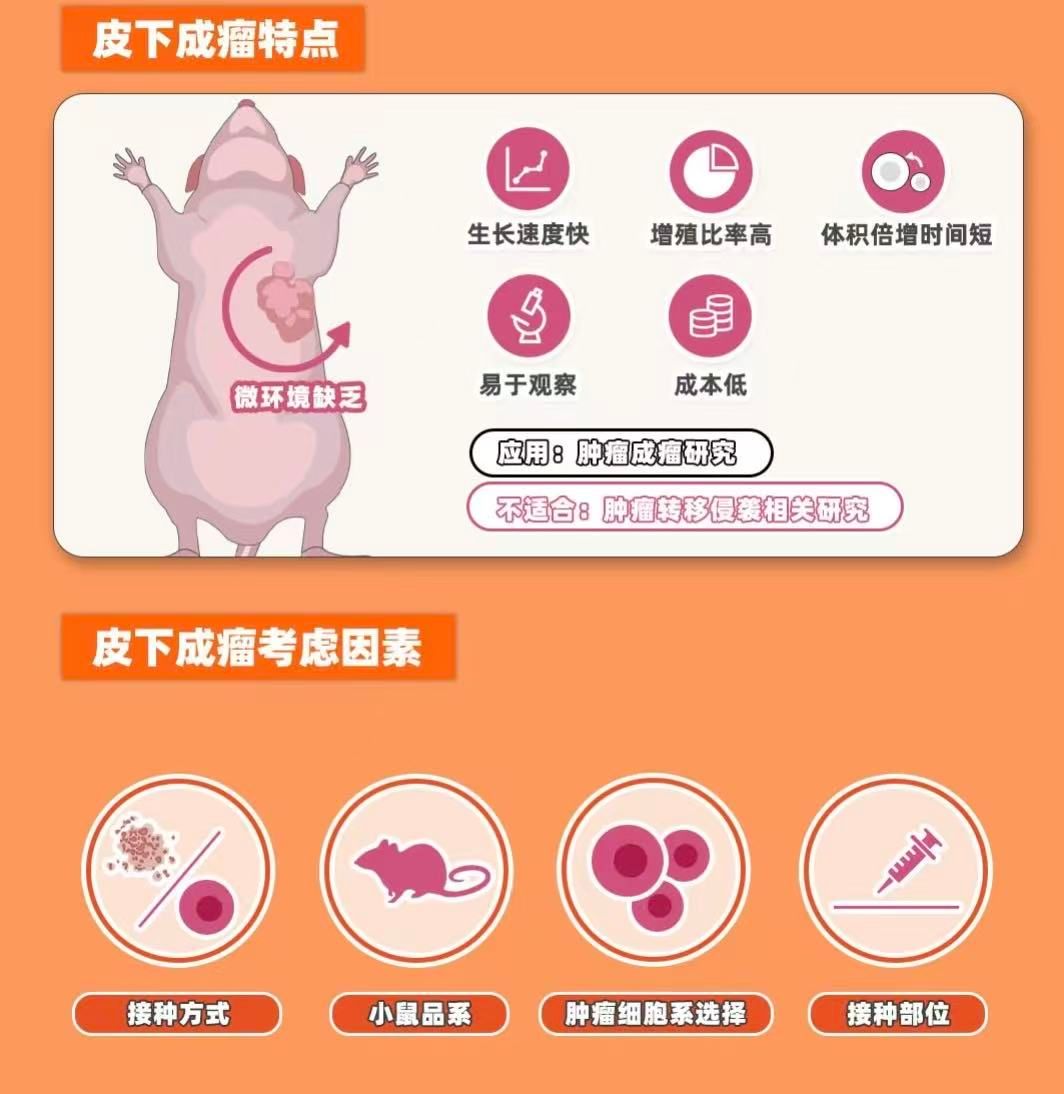
肿瘤微环境差异皮下成瘤模型无法完全模拟人体肿瘤的复杂微环境(如血管生成、免疫细胞浸润)。
转移能力有限皮下接种的肿瘤较少发生远处转移,如需研究转移,可考虑尾静脉注射或原位种植模型。